Hoá lập thể hữu cơ
+2
Unknown genius
Kiếm Phong
6 posters
Trang 1 trong tổng số 1 trang
 Hoá lập thể hữu cơ
Hoá lập thể hữu cơ
Bài này mình có viết đến một số phần chưa học, nhưng vẫn post lên để sau này có đất dùng:
1. Cách vẽ công thức chiếu Newman
Công thức chiếu này được vẽ bằng cách nhìn dọc một trục liên kết C - C và các nhóm thế được phân bố đối xứng trên mỗi nguyên tử C. Cách vẽ này sẽ dẫn đến các nguyên tử không phải nguyên tử trung tâm (tạo liên kết C - C ta nhìn) được phân bố như sau:

Để có thể vẽ được công thức Newman từ công thức chiếu phối cảnh thì điều quan trọng là ta phải đặt con mắt sao cho nằm dọc trục liên kết C - C (hãy tưởng tượng như thế nhé )
)
Giờ chúng ta sẽ xét một ví dụ, là vẽ công thức chiếu Newman của propan khi nhìn công thức của propan từ phía trái.
Cách làm như sau:
1) Vẽ vòng tròn (có tâm) để hiển thị hai nguyên tử C ở phía trước và phía sau
2) Vẽ nguyên tử H nằm trong mặt phẳng trước (vào bất kỳ chỗ nào)
3) Nguyên tử cacbon còn lại cũng có H nằm trong mặt phẳng thì ta sẽ vẽ đối xứng với nó qua tâm
4) Vẽ cấu dạng xen kẽ của công thức Newman
5) Các nhóm đi về phía người quan sát trong công thức phối cảnh được chuyển hết về bên phải
6) Các nhóm đi về phía xa người quan sát trong công thức phối cảnh được chuyển hết về phía trái
Nếu nhìn phía phải ta cũng làm tương tự
Như vậy ta sẽ vẽ được công thức Newman như sau:

2. Danh pháp R, S
Sau khi vẽ công thức chiếu phối cảnh thì bây giờ ta nhìn dọc trục liên kết C*- d, liên kết C - d buộc phải đi xa khỏi người quan sát (d là nhóm thế có độ hơn cấp nhỏ nhất, trong hình là Me) thì đồng phân R là đồng phân có các nhóm thế được sắp xếp theo chiều kim đồng hồ, còn đồng phân S thì ngược kim.

Chú ý rằng nếu nhìn vào công thức Fischer mà nhóm thế d ở cạnh ngang thì đồng phân R theo trình tự ngược kim, còn S thì cùng kim đồng hồ nhé.
3. Giới thiệu cách chuyển các công thức chiếu: Fischer - Phối cảnh - Newman:
Cách làm: Chuyển công thức Fischer về dạng che khuất của phối cảnh hay Newman rồi quay quanh C3 một góc 180 độ để được công thức bình thường hay Newman. Làm ngược lại cũng theo trình tự như vậy.
Xem ví dụ sau nhé:

1. Cách vẽ công thức chiếu Newman
Công thức chiếu này được vẽ bằng cách nhìn dọc một trục liên kết C - C và các nhóm thế được phân bố đối xứng trên mỗi nguyên tử C. Cách vẽ này sẽ dẫn đến các nguyên tử không phải nguyên tử trung tâm (tạo liên kết C - C ta nhìn) được phân bố như sau:

Để có thể vẽ được công thức Newman từ công thức chiếu phối cảnh thì điều quan trọng là ta phải đặt con mắt sao cho nằm dọc trục liên kết C - C (hãy tưởng tượng như thế nhé
 )
)Giờ chúng ta sẽ xét một ví dụ, là vẽ công thức chiếu Newman của propan khi nhìn công thức của propan từ phía trái.
Cách làm như sau:
1) Vẽ vòng tròn (có tâm) để hiển thị hai nguyên tử C ở phía trước và phía sau
2) Vẽ nguyên tử H nằm trong mặt phẳng trước (vào bất kỳ chỗ nào)
3) Nguyên tử cacbon còn lại cũng có H nằm trong mặt phẳng thì ta sẽ vẽ đối xứng với nó qua tâm
4) Vẽ cấu dạng xen kẽ của công thức Newman
5) Các nhóm đi về phía người quan sát trong công thức phối cảnh được chuyển hết về bên phải
6) Các nhóm đi về phía xa người quan sát trong công thức phối cảnh được chuyển hết về phía trái
Nếu nhìn phía phải ta cũng làm tương tự
Như vậy ta sẽ vẽ được công thức Newman như sau:

2. Danh pháp R, S
Sau khi vẽ công thức chiếu phối cảnh thì bây giờ ta nhìn dọc trục liên kết C*- d, liên kết C - d buộc phải đi xa khỏi người quan sát (d là nhóm thế có độ hơn cấp nhỏ nhất, trong hình là Me) thì đồng phân R là đồng phân có các nhóm thế được sắp xếp theo chiều kim đồng hồ, còn đồng phân S thì ngược kim.

Chú ý rằng nếu nhìn vào công thức Fischer mà nhóm thế d ở cạnh ngang thì đồng phân R theo trình tự ngược kim, còn S thì cùng kim đồng hồ nhé.
3. Giới thiệu cách chuyển các công thức chiếu: Fischer - Phối cảnh - Newman:
Cách làm: Chuyển công thức Fischer về dạng che khuất của phối cảnh hay Newman rồi quay quanh C3 một góc 180 độ để được công thức bình thường hay Newman. Làm ngược lại cũng theo trình tự như vậy.
Xem ví dụ sau nhé:


Kiếm Phong- Mê Hóa Học

- Tổng số bài gửi : 58
Join date : 02/10/2010
Age : 33
 Ảnh hưởng của cấu dạng đến tính chất Hóa học của các hợp chất vòng
Ảnh hưởng của cấu dạng đến tính chất Hóa học của các hợp chất vòng
Tiếp tục phần Hoá lập thể. Hôm nay đã học đến bài cycloankan nên tớ post bài này lên đây cho mọi người tham khảo nhé:
I. Các vấn đề về sức căng vòng
Sức căng xuất hiện trong một hợp chất khi các liên kết của hợp chất này bị "ép" để tạo thành các góc liên kết không bình thường. Có 3 loại sức căng chính đó là sức căng Baeyer, sức căng Prelog và cuối cùng là sức căng Pitze.
Trước hết ta đi vào thuyết sức căng đáng chú ý nhất,liên quan mật thiết và có sức ảnh hưởng lớn nhất khi ta xét về cấu tạo vòng cyclopropane , đó là sức căng Baeyer.
Cyclopropane là hợp chất vòng no đơn giản nhất,vì các C trên vòng đều no,nên theo lý thuyết vòng được mong đợi cấu tạo bằng mô hình tứ diện(Mô hình trong đó nguyên tử C lai hoá sp3,tạo nên 4 AO sp3 tương đương,có các góc liên kết mà cosin có giá trị là -1/3,hay 108 độ 28' 16.3'' ~ 109.5 độ). Baeyer đã cho rằng tất cả các nguyên tử carbon đều nằm trên một mặt phẳng,do đó xét đối với vòng cyclopropane, góc lk giữa 2 AO sp3 tạo nên vòng là 180:3 = 60,mà trên lý thuyết của mô hình tứ diện, góc này phải là 109 độ 28' nên ta dễ dàng suy ra độ lệch mà mỗi AO phải chịu là: (109 độ 28' - 60) : 2 = 24 độ 44'. Đối với các vòng lớn hơn, độ lệch góc anpha đuợc tính theo công thức: anpha = 1/2[109.5 - 2.90.(n-2)/n]
Và do có độ lệch này ta nói vòng cyclopropane phải chịu một sức căng,vì các liên kết trong vòng này không bình thường như các liên kết sigma khác,mà các AO liên kết đã bị uốn cong như quả chuối (Bent bonds),ta xét kĩ mô hình liên kết bị bẻ cong ở bài sau khi đi sâu phân tích cấu tạo vòng cyclopropane.
Thuyết sức căng Baeyer đã đúng khi đặt liên hệ giữa năng lượng của hợp chất với sức căng nội phân tử,và có sức thuyết phục khi thực tế chứng minh được sức căng của vòng giảm từ vòng 3 - vòng 6 cạnh là đúng.
Sức căng của một vòng là lớn hay không phụ thuộc vào Năng lượng sức căng(Strain energy)-cách tính Năng lượng sức căng cũng sẽ được trình bày ở dưới đây.
Tuy nhiên nó cũng có điểm bất hợp lý là ngoài vòng 3,các vòng lớn hơn các C không cùng nằm trên một mặt phẳng như Baeyer giả định,nếu tính theo công thức đưa ra ở trên thì ở vòng 17 cạnh sức căng lại lớn như vòng ba, tuy nhiên từ thực tế ta biết rằng mặc dù các vòng từ 7 đến 12 không loại bỏ được hết mọi sức căng như vòng 6 (vòng 6 không có sức căng,tức là như một n-alkane), và kém bền hơn vòng 6,nhưng khi n>12.mọi sức căng hầu như được loại bỏ,trái với công thức mà Baeyer đưa ra.Tuy không thực sự chính xác và đúng đắn,nhưng thuyết sức căng Baeyer đã đặt tiền đề cho việc đặt vấn đề xác định sức căng trong các hợp chất vòng.
Khép lại thuyết sức căng góc Baeyer,chúng ta chuyển sang hai loại sức căng góc còn lại.
Loại sức căng thứ hai,sức căng Prelog, còn có tên gọi là sức căng qua nhân, khi các nhóm thế ở cùng phía và gần nhau đến mức có tương tác với nhau bằng lực đẩy Van der Waals. Chúng ta lấy ví dụ ở hợp chất methylcyclohexane,trong đó e-methylcyclohexane bền hơn cấu dạng a tương ứng của nó là 7.4 kJ/mol,vì cấu dạng a- chịu lực đẩy giữa nhóm methyl và 2 nguyên tử H ở lk a cùng phía với nó,lực đẩy này được gọi là tương tác 1,3-a,a và là một ví dụ điển hình về sức căng Prelog.

Cuối cùng là sức căng Pitze, là loại sức căng gây ra bởi sự phân bố che khuất các liên kết C-H giữa hai C gần nhau. Chẳng hạn ở vòng cyclopropane cả sáu liên kết C-H đều ở dạng che khuất hoàn toàn làm xuất hiện lực đẩy tĩnh điện giữa các AO sigma C-H che khuất nhau. Ngoài sức căng Baeyer,sức căng Pitze đã đóng góp một phần không nhỏ làm cho vòng cyclopropane trở nên kém bền về mặt nhiệt động học (delta H hình thành = +53.4 kJ/mol),và kém bền nhất trong các cyclan.

Ngoài ra,trong các hợp chất vòng còn có sức căng Van der Waals (tên gọi thông dụng hơn là lực đẩy Van der Waals) do sự đẩy các nhóm thế ở C gần nhau,sức căng này tăng khi thể tich nhóm thế tăng và giảm khoảng cách so với tổng bán kính Van der Waals.
Chẳng hạn ta xét cấu dạng thuyền của vòng cyclohexane,tuy tất cả các góc đều thỉa mãn góc lai hoá sp3(có nghĩa là không tồn tại sức căng góc Baeyer),nhưng ngoài lực dẩy của 8 liên kết C-H ở cấu dạng che khuất (sức căng Pitze), còn có lực đẩy Van der Waals của hai nguyên tử H ở hai mũi thuyền (hai nguyên tử này cách nhau 183 pm, nhỏ hơn tổng bán kính Van der Waals của chúng là 2 x 124 pm),do đó cấu dạng thuyển là cấu dạng kém bền.Loại sức căng này chủ yếu gặp ở các hợp chất mạch hở khi ta xét các cấu dạng(conformers) của hợp chất đó:

Từ đó ta rút ra kết luận đối với các vòng cycloalkanes ở vòng nhỏ (3,4 cạnh) chủ yếu là do sức căng Baeyer và Pitze,vòng bình thường(5,6,7 cạnh), có sức căng nhỏ mà chủ yếu là sức căng Pitze,còng trung bình (8 đến 12 cạnh) chủ yếu do tương tác qua nhân của nhó thế(sức căng Prelog).
Bây giờ ta xét đến cách xác định năng lượng sức căng đã nói ở trên.Một phân tử có sức căng sẽ là một phân tử mà năng lượng của phân tử ấy(chính xác hơn là năng lượng tiềm ẩn trong mỗi phân tử-potential energy) là cao hơn so với lý thuyết nếu ta giả sử phân tử ấy không có sức căng. Cũng như năng lượng cộng hưởng(resonance energy)*, năng lượng sức căng không thể xác định chính xác là bao nhiêu,bởi năng lượng thực của phân tử không thể đo đếm được.Tuy nhiên ta có cách xác định năng lượng cộng hưởng cũng như năng lượng sức căng có thể tính toán được nhờ sinh nhiệt[5] (nhiệt hình thành), hay thiêu nhiệt,...
Hình vẽ bên dưới chỉ rõ cách xác định năng lượng cổng hưởng:

Lấy ví dụ cụ thể để tính năng lượng sức căng:
Cyclohexane (C6H12 hay (CH2)6) là vòng 6 cạnh, hầu như không có sức căng(từ "hầu như" ở đây là do cyclohexane có nhiều cấu dạng : bán ghế,thuyền,xoắn,ghế trong đó độ bền cấu dạng tăng dần,và cấu dạng ghế chiếm tới 99% tổng số các cấu dạng có mặt trong hỗn hợp cb các cấu dạng, cấu dạng này không có sức căng), nên thiêu nhiệt tương tự n-alkane, nên để tiện lợi người ta dùng làm chuẩn để tính năng lượng sức căng của các vòng còn lại. Sinh nhiệt của cyclohexane là -29.5 kcal/mol nên sinh nhiệt tính cho mỗi nhóm [CH2] là -29.5/6 = -4.92 kcal/mol.Nếu ta muốn tính năng lượng sức căng của vòng cyclopentane C5H10 hay (CH2)5, ta giả sử rằng vòng cyclopentane không có sức căng nên sinh nhiệt lý thuyết của cyclopentane là 5 x (-4.92) = -24.6 kcal/mol,mà trên thực tế ta thu được sinh nhiệt của vòng này lại là -18.4 kcal/mol, tức là năng lượng sức căng của vòng cyclopentane chính là sự sai lệch năng lượng của hai giá trị lý thuyết và thực nghiệm trên trên: (-18.4) - (-24.6) = 6.2 (kcal/mol).
Bài viết tham khảo nhiều sách hữu cơ, có sử dụng các hình ảnh của một số web khác.
I. Các vấn đề về sức căng vòng
Sức căng xuất hiện trong một hợp chất khi các liên kết của hợp chất này bị "ép" để tạo thành các góc liên kết không bình thường. Có 3 loại sức căng chính đó là sức căng Baeyer, sức căng Prelog và cuối cùng là sức căng Pitze.
Trước hết ta đi vào thuyết sức căng đáng chú ý nhất,liên quan mật thiết và có sức ảnh hưởng lớn nhất khi ta xét về cấu tạo vòng cyclopropane , đó là sức căng Baeyer.
Cyclopropane là hợp chất vòng no đơn giản nhất,vì các C trên vòng đều no,nên theo lý thuyết vòng được mong đợi cấu tạo bằng mô hình tứ diện(Mô hình trong đó nguyên tử C lai hoá sp3,tạo nên 4 AO sp3 tương đương,có các góc liên kết mà cosin có giá trị là -1/3,hay 108 độ 28' 16.3'' ~ 109.5 độ). Baeyer đã cho rằng tất cả các nguyên tử carbon đều nằm trên một mặt phẳng,do đó xét đối với vòng cyclopropane, góc lk giữa 2 AO sp3 tạo nên vòng là 180:3 = 60,mà trên lý thuyết của mô hình tứ diện, góc này phải là 109 độ 28' nên ta dễ dàng suy ra độ lệch mà mỗi AO phải chịu là: (109 độ 28' - 60) : 2 = 24 độ 44'. Đối với các vòng lớn hơn, độ lệch góc anpha đuợc tính theo công thức: anpha = 1/2[109.5 - 2.90.(n-2)/n]
Và do có độ lệch này ta nói vòng cyclopropane phải chịu một sức căng,vì các liên kết trong vòng này không bình thường như các liên kết sigma khác,mà các AO liên kết đã bị uốn cong như quả chuối (Bent bonds),ta xét kĩ mô hình liên kết bị bẻ cong ở bài sau khi đi sâu phân tích cấu tạo vòng cyclopropane.
Thuyết sức căng Baeyer đã đúng khi đặt liên hệ giữa năng lượng của hợp chất với sức căng nội phân tử,và có sức thuyết phục khi thực tế chứng minh được sức căng của vòng giảm từ vòng 3 - vòng 6 cạnh là đúng.
Sức căng của một vòng là lớn hay không phụ thuộc vào Năng lượng sức căng(Strain energy)-cách tính Năng lượng sức căng cũng sẽ được trình bày ở dưới đây.
Tuy nhiên nó cũng có điểm bất hợp lý là ngoài vòng 3,các vòng lớn hơn các C không cùng nằm trên một mặt phẳng như Baeyer giả định,nếu tính theo công thức đưa ra ở trên thì ở vòng 17 cạnh sức căng lại lớn như vòng ba, tuy nhiên từ thực tế ta biết rằng mặc dù các vòng từ 7 đến 12 không loại bỏ được hết mọi sức căng như vòng 6 (vòng 6 không có sức căng,tức là như một n-alkane), và kém bền hơn vòng 6,nhưng khi n>12.mọi sức căng hầu như được loại bỏ,trái với công thức mà Baeyer đưa ra.Tuy không thực sự chính xác và đúng đắn,nhưng thuyết sức căng Baeyer đã đặt tiền đề cho việc đặt vấn đề xác định sức căng trong các hợp chất vòng.
Khép lại thuyết sức căng góc Baeyer,chúng ta chuyển sang hai loại sức căng góc còn lại.
Loại sức căng thứ hai,sức căng Prelog, còn có tên gọi là sức căng qua nhân, khi các nhóm thế ở cùng phía và gần nhau đến mức có tương tác với nhau bằng lực đẩy Van der Waals. Chúng ta lấy ví dụ ở hợp chất methylcyclohexane,trong đó e-methylcyclohexane bền hơn cấu dạng a tương ứng của nó là 7.4 kJ/mol,vì cấu dạng a- chịu lực đẩy giữa nhóm methyl và 2 nguyên tử H ở lk a cùng phía với nó,lực đẩy này được gọi là tương tác 1,3-a,a và là một ví dụ điển hình về sức căng Prelog.

Cuối cùng là sức căng Pitze, là loại sức căng gây ra bởi sự phân bố che khuất các liên kết C-H giữa hai C gần nhau. Chẳng hạn ở vòng cyclopropane cả sáu liên kết C-H đều ở dạng che khuất hoàn toàn làm xuất hiện lực đẩy tĩnh điện giữa các AO sigma C-H che khuất nhau. Ngoài sức căng Baeyer,sức căng Pitze đã đóng góp một phần không nhỏ làm cho vòng cyclopropane trở nên kém bền về mặt nhiệt động học (delta H hình thành = +53.4 kJ/mol),và kém bền nhất trong các cyclan.

Ngoài ra,trong các hợp chất vòng còn có sức căng Van der Waals (tên gọi thông dụng hơn là lực đẩy Van der Waals) do sự đẩy các nhóm thế ở C gần nhau,sức căng này tăng khi thể tich nhóm thế tăng và giảm khoảng cách so với tổng bán kính Van der Waals.
Chẳng hạn ta xét cấu dạng thuyền của vòng cyclohexane,tuy tất cả các góc đều thỉa mãn góc lai hoá sp3(có nghĩa là không tồn tại sức căng góc Baeyer),nhưng ngoài lực dẩy của 8 liên kết C-H ở cấu dạng che khuất (sức căng Pitze), còn có lực đẩy Van der Waals của hai nguyên tử H ở hai mũi thuyền (hai nguyên tử này cách nhau 183 pm, nhỏ hơn tổng bán kính Van der Waals của chúng là 2 x 124 pm),do đó cấu dạng thuyển là cấu dạng kém bền.Loại sức căng này chủ yếu gặp ở các hợp chất mạch hở khi ta xét các cấu dạng(conformers) của hợp chất đó:

Từ đó ta rút ra kết luận đối với các vòng cycloalkanes ở vòng nhỏ (3,4 cạnh) chủ yếu là do sức căng Baeyer và Pitze,vòng bình thường(5,6,7 cạnh), có sức căng nhỏ mà chủ yếu là sức căng Pitze,còng trung bình (8 đến 12 cạnh) chủ yếu do tương tác qua nhân của nhó thế(sức căng Prelog).
Bây giờ ta xét đến cách xác định năng lượng sức căng đã nói ở trên.Một phân tử có sức căng sẽ là một phân tử mà năng lượng của phân tử ấy(chính xác hơn là năng lượng tiềm ẩn trong mỗi phân tử-potential energy) là cao hơn so với lý thuyết nếu ta giả sử phân tử ấy không có sức căng. Cũng như năng lượng cộng hưởng(resonance energy)*, năng lượng sức căng không thể xác định chính xác là bao nhiêu,bởi năng lượng thực của phân tử không thể đo đếm được.Tuy nhiên ta có cách xác định năng lượng cộng hưởng cũng như năng lượng sức căng có thể tính toán được nhờ sinh nhiệt[5] (nhiệt hình thành), hay thiêu nhiệt,...
Hình vẽ bên dưới chỉ rõ cách xác định năng lượng cổng hưởng:

Lấy ví dụ cụ thể để tính năng lượng sức căng:
Cyclohexane (C6H12 hay (CH2)6) là vòng 6 cạnh, hầu như không có sức căng(từ "hầu như" ở đây là do cyclohexane có nhiều cấu dạng : bán ghế,thuyền,xoắn,ghế trong đó độ bền cấu dạng tăng dần,và cấu dạng ghế chiếm tới 99% tổng số các cấu dạng có mặt trong hỗn hợp cb các cấu dạng, cấu dạng này không có sức căng), nên thiêu nhiệt tương tự n-alkane, nên để tiện lợi người ta dùng làm chuẩn để tính năng lượng sức căng của các vòng còn lại. Sinh nhiệt của cyclohexane là -29.5 kcal/mol nên sinh nhiệt tính cho mỗi nhóm [CH2] là -29.5/6 = -4.92 kcal/mol.Nếu ta muốn tính năng lượng sức căng của vòng cyclopentane C5H10 hay (CH2)5, ta giả sử rằng vòng cyclopentane không có sức căng nên sinh nhiệt lý thuyết của cyclopentane là 5 x (-4.92) = -24.6 kcal/mol,mà trên thực tế ta thu được sinh nhiệt của vòng này lại là -18.4 kcal/mol, tức là năng lượng sức căng của vòng cyclopentane chính là sự sai lệch năng lượng của hai giá trị lý thuyết và thực nghiệm trên trên: (-18.4) - (-24.6) = 6.2 (kcal/mol).
Bài viết tham khảo nhiều sách hữu cơ, có sử dụng các hình ảnh của một số web khác.

Kiếm Phong- Mê Hóa Học

- Tổng số bài gửi : 58
Join date : 02/10/2010
Age : 33
 Re: Hoá lập thể hữu cơ
Re: Hoá lập thể hữu cơ
Mấy cái phần chiều Newman sáng nay thầy giảngmình vẫn chưa thông lắm. Thanks H nhé!
 Ảnh hưởng của cấu dạng đến tính chất Hóa học của các hợp chất vòng
Ảnh hưởng của cấu dạng đến tính chất Hóa học của các hợp chất vòng
II. Khảo sát các hệ thống vòng nhỏ từ 3 - 5 cạnh
1. Vòng xiclopropan
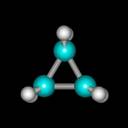
Vòng xiclopropan là một hệ thống vòng 3 cạnh phẳng trong đó các H buộc phải che khuất nhau hoàn toàn (như hình vẽ). Vòng này tồn tại một sức căng che khuất và sức căng góc lơn (sự kém bền vòng chủ yếu do sức căng góc) nên vòng sẽ trở nên kém bền và có khả năng phản ứng rất cao. Phản ứng chủ yếu là các phản ứng cộng mở vòng:

Mặt khác do cấu trúc của vòng là cứng nhắc nên sẽ có sự xuất hiện của các đồng phân hình học trong hệ thống này. Dưới đây là ví dụ minh họa với 1,2-dimetylxiclopropan:

Ngoài ra do ảnh hưởng của các liên kết "quả chuối" trong vòng xiclopropan nên kiểu lai hóa của cacbon không còn là sp3 nữa, mà trở thành trạng thái trung gian giữa sp2 và sp3.

Kết quả là nguyên tử H trong vòng xiclopropan trở nên có tính axit yếu, và tạo thành cacbanion bền vững trong một số phản ứng nhất định. Bên cạnh đó với kiểu liên kết đặc biệt này nó cho phép có khả năng tạo liên hợp với liên kết đôi để tạo thành một số sản phẩm bất thường:

2. Vòng xiclobutan

Nếu như vòng xiclobutan là phảng thì điều này tuy làm giảm đi phần nào sức căng về góc nhưng lại gây ra một sức căng che khuất lớn do có 4 cặp H - H che khuất nhau (nhìn hình vẽ). Vì vậy để giảm thiểu sức căng Pitzer thì xiclobutan buộc phải có cấu trúc không phẳng dạng giống như cánh chim (hình dưới):

Xiclobutan có khả năng chuyển hóa cấu dạng cao bằng cách đưa lần lượt các nhóm CH2 thay nhau đi ra khỏi mặt phẳng của 3 cacbon còn lại (qua trung gian phẳng) như hình vẽ:

Do trong xiclobutan sức căng che khuất đã giảm đi một ít nên khả năng tham gia phản ứng mở vòng có kém hơn so với xiclopropan. Nó không cho phản ứng mở vòng với brom mà chỉ cho phản ứng với hydro xúc tác Niken để tạo thành n - butan
Đối với các hệ thống vòng xiclobutan một lần thế thì sẽ có một cân bằng giữa cấu dạng có nhóm thế chứa vị trí trục và nhóm thế chứa vị trí xích đạo trong đó cấu dạng có nhóm thế xích đạo là cấu trạng ưu đãi (∆G = 1kcal/mol với R là Me, Br), nếu R là Cl thì sự khác biệt năng lượng chỉ là 0,49 kcal/mol
Với các xiclobutan hai lần thế có các nhóm thế ở vị trí 1,2 thì cấu dạng ưu đãi là trans (e,e)-1,2 dixiclobutan (bền hơn cis 1,3 kcal/mol đối với dẫn xuất diaxid) và cis (e,e)–1,3-dixiclobutan (bền hơn trans 0,58 kcal/mol trong dẫn xuất dibrom) do để tránh tương tác van der Waals giữa các nhóm thế.
Hình vẽ dưới đây sẽ giới thiệu cân bằng cấu dạng của dẫn xuất một lần thế cũng như cấu dạng ưu đãi của các dẫn xuất 2 lần thế 1,2- và 1,3- của xiclobutan:

1. Vòng xiclopropan

Vòng xiclopropan là một hệ thống vòng 3 cạnh phẳng trong đó các H buộc phải che khuất nhau hoàn toàn (như hình vẽ). Vòng này tồn tại một sức căng che khuất và sức căng góc lơn (sự kém bền vòng chủ yếu do sức căng góc) nên vòng sẽ trở nên kém bền và có khả năng phản ứng rất cao. Phản ứng chủ yếu là các phản ứng cộng mở vòng:

Mặt khác do cấu trúc của vòng là cứng nhắc nên sẽ có sự xuất hiện của các đồng phân hình học trong hệ thống này. Dưới đây là ví dụ minh họa với 1,2-dimetylxiclopropan:
Ngoài ra do ảnh hưởng của các liên kết "quả chuối" trong vòng xiclopropan nên kiểu lai hóa của cacbon không còn là sp3 nữa, mà trở thành trạng thái trung gian giữa sp2 và sp3.

Kết quả là nguyên tử H trong vòng xiclopropan trở nên có tính axit yếu, và tạo thành cacbanion bền vững trong một số phản ứng nhất định. Bên cạnh đó với kiểu liên kết đặc biệt này nó cho phép có khả năng tạo liên hợp với liên kết đôi để tạo thành một số sản phẩm bất thường:

2. Vòng xiclobutan

Nếu như vòng xiclobutan là phảng thì điều này tuy làm giảm đi phần nào sức căng về góc nhưng lại gây ra một sức căng che khuất lớn do có 4 cặp H - H che khuất nhau (nhìn hình vẽ). Vì vậy để giảm thiểu sức căng Pitzer thì xiclobutan buộc phải có cấu trúc không phẳng dạng giống như cánh chim (hình dưới):

Xiclobutan có khả năng chuyển hóa cấu dạng cao bằng cách đưa lần lượt các nhóm CH2 thay nhau đi ra khỏi mặt phẳng của 3 cacbon còn lại (qua trung gian phẳng) như hình vẽ:

Do trong xiclobutan sức căng che khuất đã giảm đi một ít nên khả năng tham gia phản ứng mở vòng có kém hơn so với xiclopropan. Nó không cho phản ứng mở vòng với brom mà chỉ cho phản ứng với hydro xúc tác Niken để tạo thành n - butan
Đối với các hệ thống vòng xiclobutan một lần thế thì sẽ có một cân bằng giữa cấu dạng có nhóm thế chứa vị trí trục và nhóm thế chứa vị trí xích đạo trong đó cấu dạng có nhóm thế xích đạo là cấu trạng ưu đãi (∆G = 1kcal/mol với R là Me, Br), nếu R là Cl thì sự khác biệt năng lượng chỉ là 0,49 kcal/mol
Với các xiclobutan hai lần thế có các nhóm thế ở vị trí 1,2 thì cấu dạng ưu đãi là trans (e,e)-1,2 dixiclobutan (bền hơn cis 1,3 kcal/mol đối với dẫn xuất diaxid) và cis (e,e)–1,3-dixiclobutan (bền hơn trans 0,58 kcal/mol trong dẫn xuất dibrom) do để tránh tương tác van der Waals giữa các nhóm thế.
Hình vẽ dưới đây sẽ giới thiệu cân bằng cấu dạng của dẫn xuất một lần thế cũng như cấu dạng ưu đãi của các dẫn xuất 2 lần thế 1,2- và 1,3- của xiclobutan:


Kiếm Phong- Mê Hóa Học

- Tổng số bài gửi : 58
Join date : 02/10/2010
Age : 33
 Re: Hoá lập thể hữu cơ
Re: Hoá lập thể hữu cơ
pand26: : 
 :pand26:
:pand26:

 :pand26:
:pand26:
disappear- Yêu Hóa Học

- Tổng số bài gửi : 24
Join date : 06/10/2010
 Ảnh hưởng của cấu dạng đến tính chất Hóa học của các hợp chất vòng
Ảnh hưởng của cấu dạng đến tính chất Hóa học của các hợp chất vòng
Mình sẽ bỏ qua vòng 5 cạnh cyclopentan và đến luôn với vòng 6 cạnh cyclohexan, vì vòng này khá quan trọng, chúng ta đang và còn sẽ học nhiều về nó.
1. Xiclohexan
Vòng xiclohexan là một hệ vòng đặc biệt được khảo sát kỹ lưỡng, vì bộ khung vòng xiclohexan là bộ khung chủ yếu của rất nhiều hợp chất tự nhiên và tổng hợp nên nó được khảo sát ở một phần riêng tách biệt so với các hệ thống khác:

Dựa trên các dữ kiện thực nghiệm khảo sát được thì vòng xiclohexan hoàn toàn không có sức căng. Vì thế phân tử cần phải có cấu tạo không phẳng để tránh sức căng góc và có sự sắp xếp trong không gian phù hợp để tránh được sức căng che khuất (là cấu dạng ghế như hình vẽ trên). Vào năm 1890 thì Sachse và Mohr đã đưa ra 2 cấu dạng ghế của xiclohexan, và đây là một mô hình hoàn hảo để giải thích những vấn đề về sức căng của xiclohexan. Mô hình này ban đầu được đón nhận nồng nhiệt nhưng về sau lại đi vào quên lãng vì mọi sự tách riêng ra hai cấu dạng riêng rẽ này hoàn toàn thất bại. Lý do mãi về sau mới được giải thích là do hai cấu dạng này chuyển hóa cho nhau rất nhanh ở nhiệt độ phòng qua một số các trạng thái trung gian như được biểu diễn trong sơ đồ dưới đây (Tuy nhiên những nghiên cứu gần đây cho kết quả là khi hạ nhiệt độ xuống rất thấp thì có thể phát hiện được từng cấu dạng dựa trên NMR). Rào năng lượng chuyển đổi cấu dạng là khá thấp nên mọi nghiên cứu cô lập từng cấu dạng riêng rẽ hoàn toàn thất bại.

Nhìn ở hình vẽ đầu tiên ta thấy có 6H nằm song song với trục chính của phân tử (là đường thẳng vuông góc đi qua tâm phân tử), 6H đó được gọi là 6H axial (hay 6H trục) được ký hiệu bằng màu đỏ và 6H nằm vuông góc với trục chính phân tử gọi là 6H equatorial hay 6H biên được ký hiệu bằng màu xanh. 6 cacbon của xiclohexan được phân bố trên hai mặt phẳng song song nhau, trong đó C1, 3, 5 thuộc một mặt phẳng và C2, 4, 6 thuộc mặt phẳng khác.
Trong cấu dạng ghế này hoàn toàn không tồn tại sức căng nào nên vòng xiclohexan thể hiện tính trơ hóa học mạnh. Khả năng phản ứng của nó không khác nhiều so với ankan tương ứng có cùng số cacbon.
2. Dẫn xuất một lần thế của xiclohexan
Với dẫn xuất thế một lần của xiclohexan thì tồn tại cân bằng sau:

Giá trị -∆Go hay A được gọi là năng lượng cấu dạng, ngoài việc nó cho biết cấu dạng nào chiếm ưu thế trong cân bằng chuyển đổi giữa các cấu dạng thì chúng còn cho biết một cách tương đối kích thước của các nhóm thế (nhóm thế nào có A càng lớn thì kích thước càng lớn, xác suất tồn tại ở cấu dạng trục càng nhỏ). Dưới đây là bảng giá trị A của một số nhóm thế hay gặp.

Dựa vào bảng trên thì thấy tất cả đều là các giá trị dương, tức ở đây cấu trạng với nhóm thể ở xích đạo bền hơn so với cấu trạng trục. Điều này được cho vì hai lý do: Lý do thứ nhất là với nhóm R ở vị trí trục thì sẽ tồn tại tương tác kiểu xen kẽ kề butan và bên cạnh đó là sự xuất hiện tương tác van der Waals của nhóm thế ở vị trí trục với các nguyên tử hydro ở C3 và C5, tương tác van der Waals trong trường hợp này còn được gọi là tương tác 1,3-diaxial. Ở nhóm thế xích đạo thì không có các tương tác này.

3. Dẫn xuất hai lần thế của xiclohexan
Đối với các dẫn xuất của xiclohexan mà hai nhóm thế cùng nằm trên một cacbon thì nhóm thế nào có kích thước to hơn (A lớn hơn) thì sẽ chiếm vị trí e. Còn nếu hai nhóm thế ở vị trí khác nhau thì do sự cứng nhắc của vòng nên sẽ có sự xuất hiện các đồng phân hình học. Mối quan hệ của chúng được biểu diễn như sau:
1,2-cis: ae hoặc ea
1,2-trans: aa hoặc ee
1,3-cis: aa hoặc ee
1,3-trans: ae hoặc ea
1,4-cis: ae hoặc ea
1,4-trans: aa hoặc ee
Thường các đồng phân bền vững hơn là đồng phân có nhóm thế e.
Tuy nhiên trong trường hợp nều cả hai nhóm thế đều là nhóm có thể tích lớn chẳng hạn như các nhóm tert-butyl thì sự đóng góp của các cấu trạng trung gian sẽ trở nên đáng kể. Thí dụ trong trường hợp của di-tert-butylxiclohexan thì hai nhóm t-butyl phải ở vị trí xích đạo trong cấu dạng ghế của đồng phân cis, còn một trong hai nhóm t-butyl phải ở vị trí trục trong cấu dạng ghế của đồng phân trans làm sự tương tác 1,3-diaxial sẽ trở nên rất lớn. Do đó trans-1,3-di-tert-butylxiclohexan không thể tồn tại dưới cấu trạng ghế. Để giảm bớt mức năng lượng thì câu trạng ghế phải chuyển thành cấu trạng thuyền xoắn để đảm bảo các nhóm t-butyl đều ở vị trí xích đạo.

4. Khả năng phản ứng (Phần này chưa học đến nên mọi người cứ tham khảo từ từ)
Ở đây với cấu dạng ghế thì khả năng phản ứng của các nhóm thế ở a và ở e là khác nhau. Thường thì a nhạy hơn trong các phản ứng của vòng. Ví dụ:

Điều tương tự cũng xảy ra đối với các phản ứng tách theo E2. Ở cấu dạng cần cho phản ứng tách thì các tâm phản ứng phải ở vị trí anti đối với nhau mới có thể tách loại được (do có thể tạo thành trạng thái chuyển tiếp phẳng):

1. Xiclohexan
Vòng xiclohexan là một hệ vòng đặc biệt được khảo sát kỹ lưỡng, vì bộ khung vòng xiclohexan là bộ khung chủ yếu của rất nhiều hợp chất tự nhiên và tổng hợp nên nó được khảo sát ở một phần riêng tách biệt so với các hệ thống khác:

Dựa trên các dữ kiện thực nghiệm khảo sát được thì vòng xiclohexan hoàn toàn không có sức căng. Vì thế phân tử cần phải có cấu tạo không phẳng để tránh sức căng góc và có sự sắp xếp trong không gian phù hợp để tránh được sức căng che khuất (là cấu dạng ghế như hình vẽ trên). Vào năm 1890 thì Sachse và Mohr đã đưa ra 2 cấu dạng ghế của xiclohexan, và đây là một mô hình hoàn hảo để giải thích những vấn đề về sức căng của xiclohexan. Mô hình này ban đầu được đón nhận nồng nhiệt nhưng về sau lại đi vào quên lãng vì mọi sự tách riêng ra hai cấu dạng riêng rẽ này hoàn toàn thất bại. Lý do mãi về sau mới được giải thích là do hai cấu dạng này chuyển hóa cho nhau rất nhanh ở nhiệt độ phòng qua một số các trạng thái trung gian như được biểu diễn trong sơ đồ dưới đây (Tuy nhiên những nghiên cứu gần đây cho kết quả là khi hạ nhiệt độ xuống rất thấp thì có thể phát hiện được từng cấu dạng dựa trên NMR). Rào năng lượng chuyển đổi cấu dạng là khá thấp nên mọi nghiên cứu cô lập từng cấu dạng riêng rẽ hoàn toàn thất bại.

Nhìn ở hình vẽ đầu tiên ta thấy có 6H nằm song song với trục chính của phân tử (là đường thẳng vuông góc đi qua tâm phân tử), 6H đó được gọi là 6H axial (hay 6H trục) được ký hiệu bằng màu đỏ và 6H nằm vuông góc với trục chính phân tử gọi là 6H equatorial hay 6H biên được ký hiệu bằng màu xanh. 6 cacbon của xiclohexan được phân bố trên hai mặt phẳng song song nhau, trong đó C1, 3, 5 thuộc một mặt phẳng và C2, 4, 6 thuộc mặt phẳng khác.
Trong cấu dạng ghế này hoàn toàn không tồn tại sức căng nào nên vòng xiclohexan thể hiện tính trơ hóa học mạnh. Khả năng phản ứng của nó không khác nhiều so với ankan tương ứng có cùng số cacbon.
2. Dẫn xuất một lần thế của xiclohexan
Với dẫn xuất thế một lần của xiclohexan thì tồn tại cân bằng sau:

Giá trị -∆Go hay A được gọi là năng lượng cấu dạng, ngoài việc nó cho biết cấu dạng nào chiếm ưu thế trong cân bằng chuyển đổi giữa các cấu dạng thì chúng còn cho biết một cách tương đối kích thước của các nhóm thế (nhóm thế nào có A càng lớn thì kích thước càng lớn, xác suất tồn tại ở cấu dạng trục càng nhỏ). Dưới đây là bảng giá trị A của một số nhóm thế hay gặp.

Dựa vào bảng trên thì thấy tất cả đều là các giá trị dương, tức ở đây cấu trạng với nhóm thể ở xích đạo bền hơn so với cấu trạng trục. Điều này được cho vì hai lý do: Lý do thứ nhất là với nhóm R ở vị trí trục thì sẽ tồn tại tương tác kiểu xen kẽ kề butan và bên cạnh đó là sự xuất hiện tương tác van der Waals của nhóm thế ở vị trí trục với các nguyên tử hydro ở C3 và C5, tương tác van der Waals trong trường hợp này còn được gọi là tương tác 1,3-diaxial. Ở nhóm thế xích đạo thì không có các tương tác này.

3. Dẫn xuất hai lần thế của xiclohexan
Đối với các dẫn xuất của xiclohexan mà hai nhóm thế cùng nằm trên một cacbon thì nhóm thế nào có kích thước to hơn (A lớn hơn) thì sẽ chiếm vị trí e. Còn nếu hai nhóm thế ở vị trí khác nhau thì do sự cứng nhắc của vòng nên sẽ có sự xuất hiện các đồng phân hình học. Mối quan hệ của chúng được biểu diễn như sau:
1,2-cis: ae hoặc ea
1,2-trans: aa hoặc ee
1,3-cis: aa hoặc ee
1,3-trans: ae hoặc ea
1,4-cis: ae hoặc ea
1,4-trans: aa hoặc ee
Thường các đồng phân bền vững hơn là đồng phân có nhóm thế e.
Tuy nhiên trong trường hợp nều cả hai nhóm thế đều là nhóm có thể tích lớn chẳng hạn như các nhóm tert-butyl thì sự đóng góp của các cấu trạng trung gian sẽ trở nên đáng kể. Thí dụ trong trường hợp của di-tert-butylxiclohexan thì hai nhóm t-butyl phải ở vị trí xích đạo trong cấu dạng ghế của đồng phân cis, còn một trong hai nhóm t-butyl phải ở vị trí trục trong cấu dạng ghế của đồng phân trans làm sự tương tác 1,3-diaxial sẽ trở nên rất lớn. Do đó trans-1,3-di-tert-butylxiclohexan không thể tồn tại dưới cấu trạng ghế. Để giảm bớt mức năng lượng thì câu trạng ghế phải chuyển thành cấu trạng thuyền xoắn để đảm bảo các nhóm t-butyl đều ở vị trí xích đạo.

4. Khả năng phản ứng (Phần này chưa học đến nên mọi người cứ tham khảo từ từ)
Ở đây với cấu dạng ghế thì khả năng phản ứng của các nhóm thế ở a và ở e là khác nhau. Thường thì a nhạy hơn trong các phản ứng của vòng. Ví dụ:

Điều tương tự cũng xảy ra đối với các phản ứng tách theo E2. Ở cấu dạng cần cho phản ứng tách thì các tâm phản ứng phải ở vị trí anti đối với nhau mới có thể tách loại được (do có thể tạo thành trạng thái chuyển tiếp phẳng):


Kiếm Phong- Mê Hóa Học

- Tổng số bài gửi : 58
Join date : 02/10/2010
Age : 33
 Re: Hoá lập thể hữu cơ
Re: Hoá lập thể hữu cơ
her thanks bac nhieu nhe dung cai em dang can 





huongtran- Học Hóa Học

- Tổng số bài gửi : 7
Join date : 17/10/2010
Age : 32
Đến từ : k54ahh
Trang 1 trong tổng số 1 trang
Permissions in this forum:
Bạn không có quyền trả lời bài viết|
|
|

 Trang Chính
Trang Chính

